Метод вымывания азота при множественном дыхании и структурные изменениями бронхолегочной системы у взрослых больных с муковисцидозом.
Черняк А.В. 1,2, Неклюдова Г.В. 1, Красовский С.А. 1,2, Михайличенко К.Ю. 1,3, Науменко Ж.К. 1,2, Поливанов Г.Э. 2
- Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства России. Адрес: 115682, г. Москва, Ореховый бульвар, д.28.
- Государственное бюджетное учреждение здравоохранения города Москвы «Городская клиническая больница имени Д.Д. Плетнёва Департамента здравоохранения города Москвы». Адрес: 105077, г. Москва, 11-Парковая, д.32.
- Городская клиническая больница имени М.П. Кончаловского Департамента здравоохранения города Москвы. Адрес: 124489, Зеленоград, Москва, Каштановая аллея, 2, стр. 7
Резюме
В последние десятилетия наблюдается растущий интерес к показателям индекса легочного клиренса (LCI) и отношениям моментов (MR), показателям физиологии легких, полученным с помощью метода вымывания азота при множественном дыхании (ВАМД). Было показано, что LCI и MR являются чувствительными маркерами ранних проявлений патологии бронхолегочной системы у детей с муковисцидозом (МВ), у взрослых больных подобные исследования не проводились.
Целью данной работы было оценить функциональные и структурные нарушения бронхолегочной системы, выявленные с помощью компьютерной томографией высокого разрешения (ВРКТ), у взрослых пациентов с МВ, и определить корреляцию между ними.
Материалы и методы: Данное исследование является обсервационным поперечным исследованием, в которое были включены 54 больных МВ (20 мужчин и 34 женщины, медиана возраста 25 лет) и 32 здоровых добровольцев (12 мужчин и 20 женщин, медиана возраста 25 лет). Были проведены комплексное исследование функции внешнего дыхания (ФВД: спирометрия, бодиплетизмография и измерение диффузной способности легких), ВАМД и ВРКТ. Одышка оценивалась по модифицированной шкале MRС. Измерения ВАМД проводились с использованием модуля Easy-One Pro, MBW (ndd Medical Technologies). Анализ данных ВРКТ в соответствии с классификацией, предложенной Bhalla, проводили 2 независимых опытных врача-рентгенолога, которые не знали больных МВ, их клинической картины и результатов ФВД.
Результаты. Среднее значение (±SD) ОФВ1 составило 63±26 %долж., ФЖЕЛ - 86±20 %долж., ОФВ1/ФЖЕЛ - 61±15 %, ООЛ - 220±71 %долж., ООЛ/ОЕЛ - 48±13 %, ВГО - 150±33 %долж., DLCO - 80±16 %долж. Среднее значение LCI - 16,9±5,0; MR1 - 5,0±1,7 и MR2 - 54,7±34,1. Наиболее частыми рентгеноморфологическими нарушениями (по шкале Bhalla) были бронхоэктазы (у 100 % больных) с преимущественным поражением более 9 сегментов и поражение бронхов от 5-й генерации и дистальнее. Перибронхиальная инфильтрация и мукоидные пробки также диагностировали практически у всех (94 % и 96 %, соответственно) пациентов, в то время как бронхогенные кисты или абсцессы, ателектазы/консолидация, буллы или эмфизема выявляли достаточно редко (30, 35, 20 и 17 %, соответственно). Медиана суммарного балла у взрослых больных МВ составила 11,75. Параметры ВАМД статистически значимо коррелировали как с параметрами ФВД, так и данными ВРКТ.
Заключение: У взрослых больных МВ присутствует значительная неравномерность легочной вентиляции, прогрессирующая по мере нарастания структурных повреждений бронхолегочной системы и ухудшения ФВД. Статистически значимое увеличение MR подчеркивает вовлечение в патологический процесс не только центральных, но и периферических дыхательных путей. У взрослых больных МВ существует сильная корреляционная связь между LCI и выраженностью структурных изменений, определяемых с помощью ВРКТ, сопоставимая по силе и значимости с ОФВ1.
Ключевые слова: метод вымывания азота при множественном дыхании, индекс легочного клиренса, отношение моментов, муковисцидоз, взрослые.
Муковисцидоз (МВ) – орфанное заболевание, которое характеризуется персистирующим с раннего возраста инфекционным и воспалительным процессом в органах дыхания [1], что приводит к обструкции дыхательных путей и прогрессирующему снижению функции внешнего дыхания (ФВД). Патологический процесс начинается в периферических дыхательных путях, но в конечном итоге затрагивает и более крупные дыхательные пути и приводит к нарушению их структуры и функции - бронхоэктазам. За последние десятилетия в России, как и во всем мире, был достигнут значительный прогресс в лечении МВ, что привело к увеличению продолжительности жизни больных [2,3]. В результате доля взрослых пациентов в России в 2017 году составила 22 % [4]. При этом большая часть заболеваемости и смертности при МВ вызвана заболеванием органов дыхания [1]. Регулярный мониторинг проходимости дыхательных путей позволяет своевременно проводить противовоспалительное лечение и сдерживать прогрессирование заболевания. [5-7]. В настоящее время необходим поиск еще более чувствительных методов и маркеров для выявления и оценки степени поражения бронхолегочной системы при МВ [1,5,8].
Спирометрия (объем форсированного выдоха за 1 сек (ОФВ1)) – по-прежнему самый распространенный и востребованный метод оценки бронхиальной проходимости, который можно рассматривать как первый, начальный этап исследования ФВД. Было показано, что в большинстве случаев ОФВ1 коррелирует с тяжестью симптомов и прогнозом заболевания [9-12], однако, у ряда пациентов динамика показателя ОФВ1 не позволяет прогнозировать течение заболевания. Кроме того, ОФВ1 не очень чувствителен при ранних проявлениях заболевания органов дыхания у больных МВ. [13,14]. Важную роль в диагностике функциональных нарушений и оценке прогноза у больных МВ играют и другие функциональные методы, такие как общая бодиплетизмография и диффузионный тест. Бодиплетизмография позволяет определить степень гиперинфляции легких и наличие воздушных ловушек, тогда как снижение диффузионной способности легких (DLСО) помогает идентифицировать больных МВ с тяжелой степенью легочной патологии [15]. В последние годы широкое распространение получил метод вымывания азота при множественном дыхании (ВАМД) для выявления ранних нарушений ФВД у детей с МВ и оценки неравномерности вентиляции легких. ВАМД не является новым методом, он используется с 50-ых годов 20-го века [16]. Технический прогресс сделал эту методику более доступной и менее трудоемкой, что позволило внедрить ВАМД в повседневную клиническую практику. Параметры, получаемые с помощью ВАМД, такие, как индекс легочного клиренса (LCI – lung clearance index) и отношение моментов (MR1 и MR2), позволяют диагностировать нарушение ФВД на ранних этапах и являются более сильными предикторами прогрессирования заболевания по сравнению со спирометрией [17]. Также было показано, что ВАМД, по сравнению со спирометрией (ОФВ1) или бодиплетизмографией (соотношение остаточного объема легких (ООЛ) к общей емкости легких (ОЕЛ)), позволяет лучше разграничить больных МВ с ранними проявлениями нарушений ФВД и здоровых людей [14].
В настоящее время золотым стандартом для оценки структурных изменений бронхолегочной системы является компьютерная томография грудной клетки с высоким разрешением (ВРКТ). Было показано, что ВРКТ является более чувствительным методом по сравнению со спирометрией для раннего выявления патологии органов дыхания при МВ [18-20] и для оценки прогрессирования заболевания [21,22]. При обследовании детей с МВ было продемонстрировано, что параметры ВАМД являются более чувствительными по сравнению со спирометрическими данными и могут обладать даже более высокой чувствительностью по сравнению с ВРКТ для выявления ранних патологических нарушений при МВ. В единственной отечественной работе по данной тематике, при анализе, результатов комплексного исследования ФВД и ВРКТ у взрослых больных МВ обнаружено, что количество бронхоэктазов и генерация пораженных бронхов статистически значимо коррелирует с ОФВ1, а не ООЛ [23]. При этом комплексное исследование ФВД не включало ВАМД. Таким образом, недостаточность данных о роли ВАМД в оценке взаимосвязи функциональных и структурных изменений у взрослых больных МВ определили актуальность нашего исследования.
Целью данного исследования являлась оценка функциональных и структурных нарушений у взрослых больных МВ и определение корреляционных связей между ними.
Материалы и методы
Проведено поперечное обсервационное исследование – было обследовано 57 больных МВ (23 (40 %) мужчин и 34 (60 %) женщин, в возрасте от 18 до 45 лет) и 32 здоровых добровольцев (12 мужчин (37,5 %) / 20 женщин (62,5 %), в возрасте от 22 до 40 лет). Все больные МВ проходили лечение и наблюдение в декабре 2019 - марте 2020 г.г. в ГБУЗ «ГКБ им. Д.Д. Плетнёва ДЗ г.Москвы». Среди больных МВ на момент обследования 53 (93 %) человек никогда не курили, 4 (7 %) – бывшие курильщики, индекс курения составил 2,2 пачка/лет. Диагноз муковисцидоз был установлен на основании клинической картины заболевания, генетического исследования и/или положительного потового теста. В качестве добровольцев выступали студенты и ординаторы медицинских образовательных учреждений. На момент включения в исследование 21 (66 %) человек не курили, 8 (25 %) - продолжали курить и 3 (9 %) - бросили. Среди курящих лиц индекс курения был 3,2 пачка/лет.
На момент исследования все больные МВ были в состоянии клинической ремиссии, что определялось отсутствием изменений клинических симптомов и стабильными показателями бронхиальной проходимости: ОФВ1 составлял ≥ 90 % от лучших значений за последний год. Все пациенты получали комплексную многокомпонентную терапию согласно международным и национальным рекомендациям [24]: отхаркивающее, бронхолитическое, антибактериальное, противовоспалительное, желчегонное лечение, ряд больных - заместительную терапию панкреатическими ферментами. Кроме медикаментозного лечения ряд пациентов выполнял предписания по кинезитерапии, при наличии показаний - проводилась кислородотерапия в сочетании или без неинвазивной вентиляции легких.
Всем больным МВ и добровольцам были выполнены комплексное исследование функции внешнего дыхания (ФВД) (форсированная спирометрия, бодиплетизмография, измерение диффузионной способности легких) и ВАМД. Больным МВ все функциональные исследования проводили после физиотерапии и ингаляционной лекарственной терапии. Исследования проводились с помощью диагностической системы MasterScreen-Body/Diff (CareFusion, Германия), тест ВАМД – с помощью Easy-One Pro, MBW Module (ndd Medical Technologies, Швейцария). Все диагностические процедуры были выполнены в один и тот же день, одним и тем же врачом. Спирометрия, бодиплетизмография и диффузионный тест выполнены с соблюдением стандартов качества исследований Американского торакального общества (АТО) и Европейского респираторного общества (ЕРО) [25-27]. DLCO оценивали при однократном вдохе газовой смеси, содержащей монооксид углерода (СО), с задержкой дыхания [27]. Проведение теста ВМД осуществляли согласно рекомендациям АТО/ЕРО 2013 года [28]: дыхательный объем во время ВАМД составлял примерно 1 литр (в диапазоне 950-1400 мл). Повторное измерение делали через промежуток времени, рассчитанный автоматически с помощью программного обеспечения и достаточный для восстановления концентрации азота в выдыхаемом воздухе до исходного значения. Для каждого пациента регистрировали среднее значение не менее трех воспроизводимых технически удовлетворительных измерений [28]. Трое больных МВ из-за кашля не смогли выполнить ВАМД, и были исключены из исследования. Таким образом, анализировали данные 54 больных МВ (20 (37 %) мужчин и 34 (63 %) женщин, средний возраст 26,3±6,5 лет).
Анализировали следующие параметры:
1) спирометрии: форсированную жизненную емкость легких (ФЖЕЛ), ОФВ1, ОФВ1/ФЖЕЛ, ОФВ1/ЖЕЛ (ЖЕЛ – жизненную емкость легких), среднюю объемную скорость на участке кривой поток-объем форсированного выдоха между 25 и 75% ФЖЕЛ (СОС25-75);
2) бодиплетизмографии: ЖЕЛ, ОЕЛ, ООЛ, ООЛ/ОЕЛ, внутригрудной объем газа (ВГО), общее бронхиальное сопротивление (Rawобщ);
4) диффузионного теста: DLCO и отношение DLCO к альвеолярному объему (VA) (KCO);
5) ВАМД: функциональную остаточную емкость легких (ФОЕ), LCI, MR1 и MR2.
При анализе показателей, полученных в результате комплексного исследования ФВД, использовали должные значения для общей популяции, которые рассчитывали по формулам Европейского объединения угля и стали (ECSC, 1993) [29] с учетом антропометрических характеристик (пол, возраст и рост). Результаты выражали в процентах от должного значения (%долж.): полученное значение/должное значение ×100%. Показатели ВАМД больных МВ сравнивали с аналогичными показателями, полученными у добровольцев. Перед исследованием ФВД измеряли рост и массу тела (без обуви и верхней одежды).
У больных МВ оценивали также одышку с помощью модифицированной шкалы Medical Research Council (mMRC): от 0 (одышка только при очень интенсивной нагрузке) до 4 (одышка не позволяет выйти из дома или появляется при одевании или раздевании) [30].
В генетическом cтатусе больных МВ доминировали «тяжелые» генотипы, которые выявлены у 34 пациентов. Микробиологический профиль респираторного тракта был представлен преимущественно грамотрицательной флорой (45 пациентов), среди которой хроническое инфицирование P.aeruginosa выявлено у 42 больных, у троих пациентов верифицирована инфекция Achromobacter spp. Дыхательные пути 9 пациентов были инфицированы S.aureus.
ВРКТ проводили всем больным МВ на 160-срезовом спиральном компьютерном томографе Aquilion PRIME 160 (Тoshiba, Япония) в интервале ±2 дня от функционального исследования. Сканирование выполнялось на глубоком вдохе пациента с толщиной среза 0,5 мм в спиральном режиме томографирования.
Структуру легочной ткани оценивали в легочном окне (ширина 1 600 ЕдХ, уровень – 550 ЕдХ.). Оценка структуры средостения проводилась в средостенном окне (ширина – 400 ЕдХ, уровень 40 ЕдХ).
Выраженность структурных изменений органов грудной клетки оценивали для каждого больного МВ в соответствии с классификацией, предложенной Bhalla с коллегами [31], 2 независимых опытных врача-рентгенолога, которые не знали больных МВ, их клинической картины и результатов ФВД. Каждый врач-рентгенолог анализировал компьютерные томограммы и выставлял баллы на основании выраженности и распространенности 9 рентгеноморфологических признаков: выраженность бронхоэктазов, перибронхиальная инфильтрация, количество бронхоэктазов, количество мукоидных пробок, бронхогенные кисты или абсцессы, генерация пораженных бронхов, количество булл, эмфизематозные изменения, а также ателектаз или консолидация [31]. Кроме того, вычисляли суммарный балл. Баллы, полученные врачами-рентгенологами, по каждому рентгеноморфологическому признаку для каждого больного МВ суммировались и делились на 2. В статистический анализ, таким образом, брали средние значения.
Протокол исследования был одобрен этическим комитетом ФГБУ «НИИ пульмонологии» ФМБА России (N 06-19, от 18.12.2019).
Статистическая обработка результатов выполнена методами описательной статистики с применением прикладного пакета программ STATISTICA 10.0 (StatSoft Inc., США). Данные анализировались на соответствие распределения значений изучаемого показателя закону нормального распределения (W-тест Шапиро-Уилка). Данные представлены как среднее ± стандартное отклонение (SD), медианы (Ме) (нижний квартиль; верхний квартиль). Количество пациентов (n) использовалось для категориальных переменных. Категориальные переменные сравнивались с использованием точного критерия Фишера, непрерывные переменные - с помощью t-критерия Стьюдента или U-критерия Манна-Уитни. Корреляционный анализ проводили с использованием ранговой корреляции Спирмена. Различия считались статистически значимыми при p<0,05.
Результаты
В группе обследованных больных МВ среднее значение ОФВ1 составило 62,6±26,0 %долж. Медиана одышки была равна 0 (0-1) баллов по шкале mMRC. У добровольцев не было выявлено нарушений легочной вентиляции и легочного газообмена. Характеристика больных МВ и добровольцев, а также значения показателей легочной вентиляции, легочного газообмена и ВАМД представлены в таблице
Таблица 1. - Характеристика больных с муковисцидозом и здоровых добровольцев.
| Показатель | Больные МВ n=54 | Добровольцы, n= 32 |
| Возраст, дет | 26,3±6,5 25,0 (21,0-31,0) | 26,5±4,4 25,0 (23,0-28,5) |
| Пол, М/Ж | 20/34 | 12/20 |
| Курение, (Да/Нет) | 0/54 | 8/24 |
| Рост, см | 166±8 166 (158-172) | 171±9 171 (166-176) * |
| ИМТ, кг/м2 | 19,7±2,7 19,2 (18,0-21,5) | 23,1±4,2 22,1 (19,7-25,1) *** |
| ФЖЕЛ, %долж. | 86,1±20,3 89,3 (67,9-100,7) | 113,3±10,3 115,3 (104,9-118,3) *** |
| ОФВ1, %долж. | 62,6±26,0 58,9 (40,0-84,6) | 108,2±9,9 108,7 (99,5-116,8) *** |
| ОФВ1/ФЖЕЛ, % | 60,6±15,1 60,4 (48,7-73,6) | 82,3±7,2 81,9 (76,8-89,2) *** |
| СОС25-75, %долж. | 32,5±27,2 21,7 (10,6-50,1) | 89,5±20,3 89,3 (74,1-101,1) *** |
| ЖЕЛ, %долж. | 86,0±19,6 87,9 (69,1-98,4) | 111,6±9,7 113,6 (104,1-118,4) *** |
| ОЕЛ, %долж. | 123,3±14,8 119,8 (110,5-134,4) | 122,6±10,0 122,2 (118,6-129,6) |
| ВГО, %долж. | 150,3±32,9 145,2 (129,0-166,1) | 134,4±17,2 134,3 (124,4-145,1) * |
| ООЛ, %долж. | 220,1±70,8 214,0 (160,6-273,1) | 148,8±27,7 139,6 (125,7-167,3)*** |
| ООЛ/ОЕЛ, % | 47,7±12,9 45,4 (35,8-57,9) | 31,9±5,5 31,3 (27,7-35,6) *** |
| Rawобщ, кПа·сек/л | 0,58±0,31 0,50 (0,32-0,75) | 0,20±0,07 0,20 (0,16-0,25) *** |
| DLCO, %долж. | 79,9±16,1 79,3 (70,5-91,1) | 92,6±11,3 94,0 (84,0-101,2) *** |
| KCO, %долж. | 98,4±11,7 97,2 (90,4-105,8) | 89,2±11,1 90,8 (79,5-96,9) *** |
| ФОЕ, %долж. | 94,2±21,9 92,5 (76,0-109,0) | 108,1±19,4 106,5 (95,0-116,5) ** |
| ВГО-ФОЕ, л | 1,60±0,86 1,42 (1,15-1,99) | 0,78±0,40 0,84 (0,49-1,02) *** |
| LCI | 16,92±4,97 17,42 (12,56-20,62) | 7,16±0,74 7,17 (6,63-7,59) *** |
| ДО, л | 0,84±0,23 0,92 (0,61-1,00) | 0,97±0,21 1,03 (0,94-1,11) * |
| ЧД, 1/мин | 15,5±4,1 15,5 (13,1-16,9) | 15,6±3,0 16,1 (14,0-17,6) |
| M0 | 1,57±0,16 1,58 (1,46-1,68) | 1,28±0,09 1,27 (1,23-1,31) *** |
| MR1 | 4,95±1,68 5,08 (3,47-6,02) | 1,94±0,19 1,92 (1,85-2,02) *** |
| MR2 | 54,74±34,12 53,19 (26,37-73,33) | 7,13±1,60 6,82 (6,13-7,77)*** |
Примечание: Данные представлены как среднее ± стандартное отклонение, медиана (нижний квартиль-верхний квартиль) или как количество пациентов (n) для категориальных переменных; долж. – должное значение переменной (ECSC, 1993) [29]; * - p<0,05; ** - p<0,01; *** - p<0,001 при сравнении больных с муковисцидозом и добровольцев.
Вымывание азота при множественном дыхании
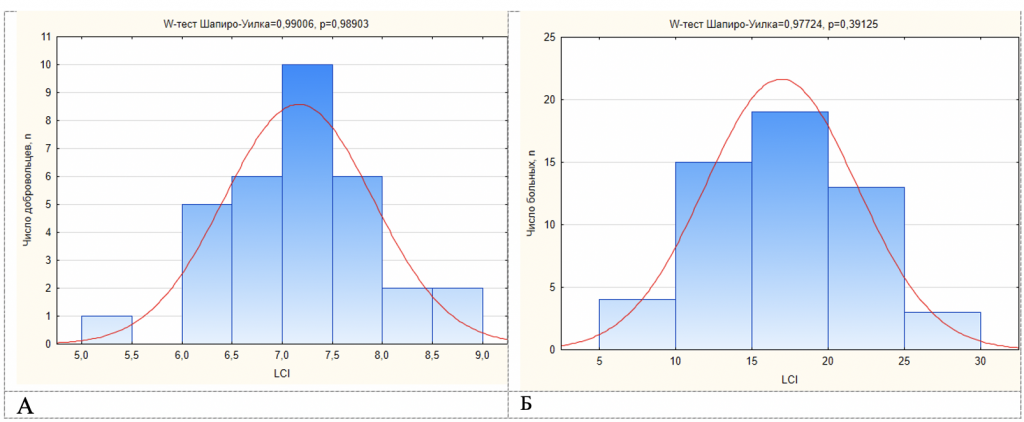
В группе добровольцев был определен нормальный диапазон значений основных параметров ВАМД (90% доверительный интервал (ДИ) вычисляли как среднее ± 1,645 * стандартное отклонение): для LCI 7,16±1,645*0,74 (табл.1), т.е. 90%ДИ = 5,94-8,39 (рис.1); для M0 1,28±1,645*0,09 (табл.1), 90%ДИ=1,13-1,43; для MR1 1,95±1,645*0,21 (табл.1), 90%ДИ=1,61-2,29; для MR2 7,22±1,645*1,92 (табл.1), 90%ДИ=4,07-10,38.
В группе больных МВ такие параметры ВАМД, как LCI, M0, MR1 и MR2 были статистически значимо выше, чем в группе добровольцев (табл.1). Только у 2 человек значения LCI были в пределах нормального диапазона (рис.1), а MR1 и MR2 – у 1 пациента.
Рисунок 1. Распределение индекса легочного клиренса (LCI) А) в группе здоровых добровольцев и Б) в группе больных с муковисцидозом (МВ). Среднее значение LCI в группе добровольцев составило 7,16; стандартное отклонение 0,74. Таким образом, верхняя граница нормы 8,39 (7,16 + 1,645 *0,74). В группе больных МВ среднее значение LCI – 16,92, только у 2 больных МВ значение LCI были сохранными.
Комплексное исследование функции внешнего дыхания
В группе больных МВ по данным комплексного исследования ФВД средние значения показателей легочной вентиляции были характерны для умеренных обструктивных нарушений, с сохранной ЖЕЛ, сниженным ОФВ1 до 63 %долж., сниженным отношением ОФВ1/ФЖЕЛ до 61 %, наличием гиперинфляции легких (ВГО=150 %долж.), воздушных ловушек (ООЛ увеличен до 220 %долж., его доля в структуре ОЕЛ до 48 %) и увеличением сопротивления дыхательных путей (табл.1). У 9 (16,7 %) человек обструктивных нарушений по данным спирометрии не было выявлено (ОФВ1 более 80 %долж., ОФВ1/ФЖЕЛ не снижено), тогда как у 45 больных - обструктивные нарушения (ОФВ1/ФЖЕЛ снижено, ОЕЛ более 80 %долж.) различной степени тяжести: очень тяжелые обструктивные нарушения (ОФВ1 менее 35 %долж.) были выявлены у 8 (14,8 %) больных МВ, тяжелые (ОФВ1 от 35 до 50 %долж.)– у 13 (24,1 %) больных, среднетяжелые (ОФВ1 от 50 до 60 %долж.)– у 7 (13,0 %) больных, умеренные (ОФВ1 от 60 до 70 %долж.)– у 3 (5,6 %) пациентов, легкие (ОФВ1 более 70 %долж.)– у 14 (25,9 %) больных.
Средние значения показателей легочного газообмена в группе больных МВ были сохранными (табл.1), однако у 23 (42,6 %) больных отмечалось снижение DLCO пропорциональное снижению альвеолярного объема; KCO был сохранным у всех обследованных больных МВ.
В группе добровольцев ни у одного из обследованных не было выявлено нарушений легочной вентиляции или легочного газообмена.
Компьютерная томография грудной клетки с высоким разрешением
При анализе компьютерных томограмм больных МВ 2 независимыми врачами-рентгенологами были получены хорошо сопоставимые результаты. Результаты анализа по каждому из 9 рентгеноморфологических признаков классификации Bhalla представлены в таблице 2. Медиана суммарного балла у взрослых больных МВ составила 11,75 (8,50-13,50).
У всех больных были выявлены бронхоэктазы (малые – у 28 %, средние – у 35 %, большие – у 13 % больных МВ, еще в 24 % случаев мнения разделились малые или средние – 7 %, средние или большие – 17 %) с преимущественным поражением более 9 сегментов (у 59 % больных). Перибронхиальную инфильтрацию диагностировали у 94 % больных (в основном с утолщением стенки до 1-2 диаметров сопутствующего сосуда - 82 %), мукоидные пробки – у 96 % больных, в основном в 1–9-м сегментах (72 %). Поражение бронхов до 4-й генерации было обнаружено у 1 (2 %) больного МВ, до 5-й генерации – у 7 (13 %) больных, до 6-й генерации или дистальнее – у 31 (57 %), еще в 28 % случаев интерпретация рентгенологов была промежуточной между 5 и 6 генерациями пораженных бронхов). При этом бронхогенные кисты или абсцессы, буллы, эмфизематозные изменения и ателектазы/консолидация выявляли достаточно редко (30, 20, 17 и 35 %, соответственно).
Таблица 2. - Структурные изменения, выявленные с помощью компьютерной томографии грудной клетки с высоким разрешением, у взрослых больных с муковисцидозом (по шкале Bhalla [31]).
| ВБ | ПИ | КБ | КМП | БКиА | ГПБ | Б | Э | АиК | |
| Медиана | 2,0 | 1,5 | 3,0 | 1,75 | 0,0 | 3,0 | 0,0 | 0,0 | 0,0 |
| НК-ВК | 1,0-2,5 | 1,0-2,0 | 2,0-3,0 | 1,0-2,0 | 0,0-0,5 | 2,5-3,0 | 0,0-0,0 | 0,0-0,0 | 0,0-0,5 |
| Норма, n (%) | 0 (0) | 3 (5,6) | 0 (0) | 2 (3,7) | 38 (70,4) | 0 (0) | 43 (79,6) | 45 (83,3) | 35 (64,8) |
Примечание: ВБ - выраженность бронхоэктазов; ПИ - перибронхиальная инфильтрация; КБ- количество бронхоэктазов; КМП -количество мукоидных пробок; БКиА - бронхогенные кисты или абсцессы; ГПБ - генерация пораженных бронхов; Б - количество булл; Э – эмфизематозные изменения; АиК – Ателектаз или консолидация. НК - нижний квартиль; ВК - верхний квартиль.
Корреляционные связи между параметрами вымывания азота при множественном дыхании и функции внешнего дыхания, данными компьютерной томографии грудной клетки с высоким разрешением
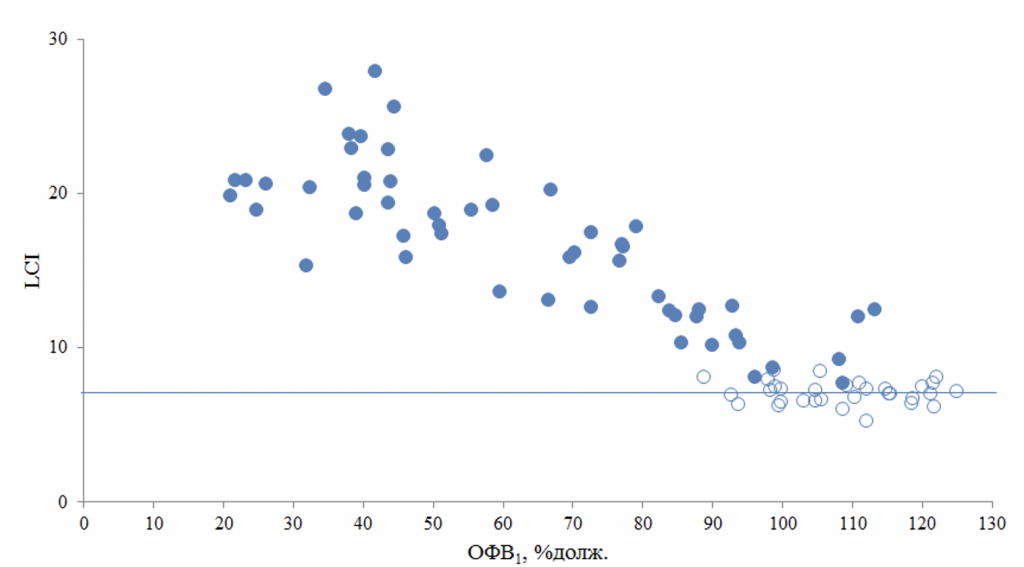
У больных МВ параметры ВАМД статистически значимо коррелировали с параметрами ФВД (табл.3): наиболее сильная корреляционная связь была между ОФВ1 и LCI, MR1 (рис.3). Тогда как у здоровых добровольцев были выявлены статистически значимые корреляционные связи только между ФОЕ и параметрами бодиплетизмографии (RОЕЛ=0,609, p<0,001; RООЛ = 0,689, p<0,001; RООЛ/ОЕЛ = 0,435, p=0,013; RВГО = 0,778, p<0,001; RВГО-ФОЕ-= 0,479, p=0,006).
Таблица 3. - Коэффициент ранговой корреляции Спирмена (R) между параметрами вымывания азота при множественном дыхании и функции внешнего дыхания у больных с муковисцидозом.
| ФОЕ, %долж. | LCI | M0 | MR1 | MR2 | |
| ФЖЕЛ, %долж. | -0,004 | -0,694*** | -0,586*** | -0,647*** | -0,625*** |
| ОФВ1, %долж. | -0,202 | -0,834*** | -0,771*** | -0,806*** | -0,773*** |
| ОФВ1/ФЖЕЛ, % | -0,269* | -0,770*** | -0,798*** | -0,758*** | -0,721*** |
| СОС25-75, %долж. | -0,180 | -0,808*** | -0,799*** | -0,785*** | -0,750*** |
| ЖЕЛ, %долж. | 0,027 | -0,605*** | -0,538*** | -0,556*** | -0,535*** |
| ОЕЛ, %долж. | 0,437*** | 0,309* | 0,395** | 0,357** | 0,313* |
| ООЛ, %долж. | 0,376** | 0,743*** | 0,718*** | 0,732*** | 0,687*** |
| ООЛ/ОЕЛ, % | 0,174 | 0,761*** | 0,743*** | 0,752*** | 0,711*** |
| ВГО, %долж. | 0,590*** | 0,659*** | 0,716*** | 0,656*** | 0,610*** |
| Rawобщ, кПа·сек/л | -0,034 | 0,672*** | 0,581*** | 0,681*** | 0,654*** |
| DLCO, %долж. | -0,244 | -0,724*** | -0,541*** | -0,697*** | -0,666*** |
| KCO, %долж. | -0,396** | -0,207 | -0,131 | -0,246 | -0,219 |
| ВГО-ФОЕ, л | -0,155 | 0,379** | 0,459*** | 0,367** | 0,328* |
Примечание: * - p<0,05; ** - p<0,005; *** - p<0,001
Рисунок 3. Изменение индекса легочного клиренса (LCI) и отношений моментов 1 (MR1) в зависимости от объема форсированного выдоха за первую секунду (ОФВ1) у больных с муковисцидозом (●) и у добровольцев (○). Должное значение LCI = 7,16 указано как синяя горизонтальная линия.
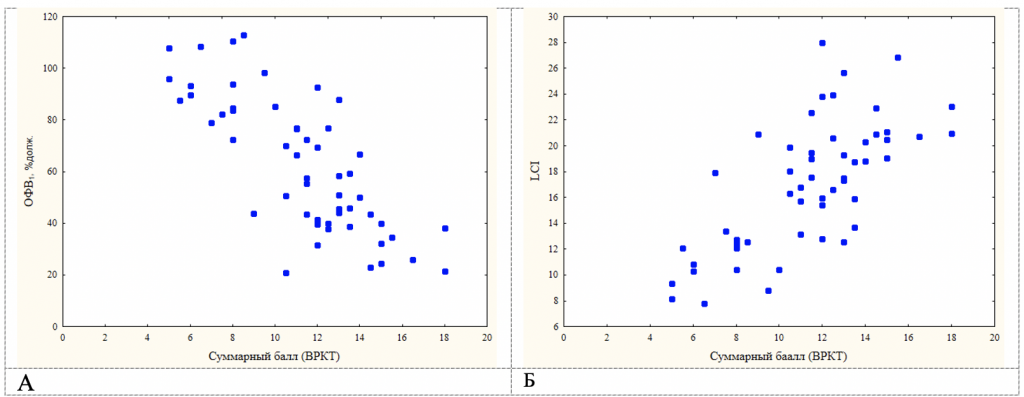
Параметры ВАМД, ФВД статистически значимо коррелировали с данными ВРКТ взрослых больных МВ (табл.4). Наиболее сильные корреляционные связи (R>0,70) были выявлены между суммарным баллом по ВРКТ и ОФВ1 (рис.4а), LCI (рис.4б), степенью воздушных ловушек (ООЛ и ООЛ/ОЕЛ) (табл.4). Между выраженностью бронхоэктазов и их количеством, генерацией пораженных бронхов были средние корреляционные связи (0,50<R<0,69) с данными ФВД и ВАМД, наиболее значимые с ОФВ1, степенью воздушных ловушек и LCI (в порядке убывания R), тогда как с перибронхиальной инфильтрацией, количеством мукоидных пробок и количеством булл наиболее статистически значимыми корреляционные связи были с LCI, MR2 и ООЛ, а не ОФВ1 (табл.4). Эмфизематозные изменения также лучше коррелировали с ВГО, ООЛ и LCI.
Таблица 4. - Коэффициент ранговой корреляции Спирмена (R) между параметрами вымывания азота при множественном дыхании, функции внешнего дыхания и рентгеноморфологическими признаками компьютерной томографии грудной клетки с высоким разрешением у больных с муковисцидозом.
| ВБ | ПИ | КБ | КМП | БКиА | ГПБ | Б | Э | АиК | СБ | |
| LCI | 0,530*** | 0,578*** | 0,681*** | 0,654*** | 0,074 | 0,490*** | 0,503*** | 0,405** | 0,100 | 0,714*** |
| M0 | 0,402** | 0,377** | 0,567*** | 0,508*** | 0,038 | 0,446** | 0,426** | 0,417** | -0,082 | 0,547*** |
| MR1 | 0,503*** | 0,567*** | 0,658*** | 0,645*** | 0,029 | 0,474*** | 0,458*** | 0,375** | 0,111 | 0,683*** |
| MR2 | 0,503*** | 0,585*** | 0,653*** | 0,658*** | 0,021 | 0,484*** | 0,416** | 0,341* | 0,128 | 0,684*** |
| ФОЕ, %долж. | 0,018 | 0,118 | 0,177 | 0,259 | -0,049 | 0,063 | 0,431** | 0,301* | -0,226 | 0,189 |
| ФЖЕЛ, %долж. | -0,596*** | -0,567*** | -0,640*** | -0,390** | -0,239 | -0,376** | -0,243 | -0,194 | -0,141 | -0,616*** |
| ОФВ1, %долж. | -0,634*** | -0,566*** | -0,705*** | -0,566*** | -0,219 | -0,577*** | -0,411** | -0,395** | -0,126 | -0,752*** |
| ЖЕЛ, %долж. | -0,591*** | -0,552*** | -0,605*** | -0,336* | -0,257 | -0,345* | -0,178 | -0,114 | -0,113 | -0,573*** |
| ОЕЛ, %долж. | 0,132 | 0,129 | 0,259 | 0,407** | -0,045 | 0,290* | 0,472*** | 0,516*** | -0,010 | 0,364** |
| ООЛ, %долж. | 0,570*** | 0,477*** | 0,686*** | 0,607*** | 0,180 | 0,512*** | 0,488*** | 0,485*** | 0,049 | 0,732*** |
| ООЛ/ОЕЛ, % | 0,640*** | 0,570*** | 0,701*** | 0,540*** | 0,248 | 0,475*** | 0,390** | 0,353** | 0,140 | 0,729*** |
| ВГО, %долж. | 0,442** | 0,346* | 0,589*** | 0,548*** | 0,112 | 0,486*** | 0,494*** | 0,536*** | -0,011 | 0,617*** |
| Rawобщ, кПа·сек/л | 0,469*** | 0,403** | 0,552*** | 0,445** | 0,166 | 0,442** | 0,280* | 0,227 | 0,182 | 0,578*** |
| DLCO, %долж. | -0,442** | -0,473*** | -0,560*** | -0,357** | -0,090 | -0,295* | -0,415** | -0,200 | -0,111 | -0,518*** |
| KCO, %долж. | 0,024 | -0,022 | -0,054 | 0,057 | 0,089 | -0,047 | -0,279* | -0,157 | -0,033 | -0,032 |
| ВГО-ФОЕ, л | 0,348* | 0,218 | 0,425** | 0,380** | 0,100 | 0,544*** | 0,232 | 0,443** | 0,178 | 0,483*** |
Примечание: ВБ - выраженность бронхоэктазов; ПИ - перибронхиальная инфильтрация; КБ- количество бронхоэктазов; КМП - количество мукоидных пробок; БКиА - бронхогенные кисты или абсцессы; ГПБ - генерация пораженных бронхов; Б - количество булл; Э – эмфизематозные изменения; АиК – Ателектаз или консолидация; СБ –суммарный балл. * - p<0,05; ** - p<0,01; *** - p<0,001
Рисунок 4. Изменение объема форсированного выдоха за первую секунду (ОФВ1) (А) и индекса легочного клиренса (LCI) (Б) у взрослых больных с муковисцидозом в зависимости от выраженности структурных изменений (суммарного балла), выявленных с помощью компьютерной томографии грудной клетки с высоким разрешением (ВРКТ).
Обсуждение
Поиск оптимального диагностического метода для оценки поражения органов дыхания продолжает быть актуальным при МВ. Одной из методик, хорошо зарекомендовавшей себя у детей с МВ, является метод вымывания азота при множественном дыхании.
В данном поперечном обсервационном исследовании, включающим большую когорту больных МВ (n=54) и здоровых добровольцев (n=32), было продемонстрировано, что у взрослых больных МВ преобладали обструктивные нарушения от среднетяжелой до очень тяжелой степени, с выраженной гиперинфляцией легких, наличием воздушных ловушек. Снижение диффузионной способности легких пропорциональное снижению альвеолярного объема наблюдалось у 43 % больных МВ. Нарушение равномерности легочной вентиляции было выявлено у подавляющего большинства взрослых больных (в 96 % случаев).
ВАМД – метод не новый, но благодаря техническому прогрессу, он получил второе рождение в начале 21-го века. В последние десятилетия тест ВАМД используют чаще для оценки неравномерности легочной вентиляции и функции периферических дыхательных путей, что имеет большое клиническое значение в ранней диагностике респираторных заболеваний. Большим преимуществом данного метода является простота в проведении исследования: пациент дышит спокойно (дыхательный объем в диапазоне 950-1400 мл) и непрерывно в течение определенного времени, не прилагая усилий и не совершая форсированные маневры. Тест хорошо стандартизован [28]. Однако, у больных МВ могут возникнуть проблемы при измерении как из-за необходимости дышать с определенным уровнем дыхательного объема (особенно при резко выраженных обструктивных нарушениях), так и вследствие преждевременного прекращения тестирования из-за кашля, обильного слюноотделения и невозможности дышать достаточно длительное время, не отрываясь от мундштука. В нашем исследовании не смогли выполнить ВАМД трое больных МВ, поэтому они были исключены из исследования.
Используя метод вымывания азота, мы смогли доказать не только выраженную неоднородность вентиляции у взрослых больных МВ, усиливающуюся по мере прогрессирования структурных изменений, но также оценить степень воздушных ловушек. Как известно, с помощью ВАМД можно измерить ФОЕ, но в отличие от бодиплетизмографии, этот объем представляет собой только вентилируемый объем газа, то есть объем, находящийся в вентилируемых участках легких при спокойном дыхании. Поэтому разница между ВГО и ФОЕ, измеренной при ВАМД, является надежной мерой измерения невентилируемого объема легких – воздушной ловушки [32]. В исследовании мы показали, что у взрослых больных МВ разница ВГО-ФОЕ практически вдвое превышает нормальные значения (1,42 vs 0,84, p<0,001).
Больные МВ, особенно взрослые больные, характеризуются выраженными структурными изменения органов дыхания. В нашем исследовании все пациенты МВ имели бронхоэктазы, даже у 7 больных с сохранной ФВД. LCI был выше верхней границы нормы у 52 (96 %) пациентов, при этом у одного из 2 обследованных с нормальными значениями LCI отмечалось увеличение отношение моментов (MR1, MR2), что указывает на ранние проявления дисфункции периферических дыхательных путей [19,32,33]. MR выходил за нормальный диапазон значений практически у всех обследованных больных (у 53 из 54). Это подчеркивает вовлечение в патологический процесс не только центральных, но и периферических дыхательных путей. Предполагают, что показатель MR2 может быть наиболее чувствительным маркером дисфункции мелких дыхательных путей по сравнению с остальными параметрами ВАМД [33]. Кроме того, было показано, что увеличение именно MR2 связано с прогрессированием заболевания [33]. Недостатком MR является высокая вариабельность и отсутствие четких стандартов вычисления. Параметр вычисляется для каждого пациента индивидуально при достижении конечной концентрации вымывания, число дыхательных циклов при этом существенно различается. Это затрудняет сравнение между пациентами. Для стандартизации вычисления MR предлагали обрезать кривую вымывания на 8 или 10 цикле [32]. Поэтому в настоящее время MR не нашел широкого применения в клинической практике, основная область его применения – клинические исследования.
При оценке структурных изменений, определяемых с помощью ВРКТ, обращает внимание, что буллезные и эмфизематозные изменения у взрослых больных МВ встречаются нечасто (20 и 17 %, соответственно). Похожие результаты были получены и в ряде других исследований [23,34]. Эти данные указывают, что МВ является в большей степени болезнью проводящих дыхательных путей, а не респираторной зоны. Мы выявили, что коэффициент корреляции между суммарным баллом, учитывающим все 9 рентгеноморфологических признаков, и LCI был сильным и близким по силе ОФВ1. Тогда как статистически значимые корреляционные связи между буллезными и эмфизематозными изменениями и параметрами ВАМД (LCI и MR) были более сильные по сравнению с ОФВ1. Во многих работах было показано, что чувствительность параметров ВАМД для диагностики патологии органов дыхания при МВ сопоставима с данными ВРКТ и превосходит чувствительность ОФВ1 [35-37]. Однако, основным контингентом в этих исследованиях были дети и подростки, с ранними проявлениями патологии органов дыхания. Так в работе Gustafsson PM с коллегами было обследовано 44 пациента в возрасте от 5 до 19 лет с наличием бронхоэктазов у 26 (59 %) человек и с воздушными ловушками у 16 (36 %) пациентов по данным ВРКТ, с нормальным значением ОФВ1 у 37 (84 %) пациентов [35]. В исследовании Ellemunter H с коллегами были включены больные МВ (n=34) в возрасте от 6 до 26 лет с ранними проявлениями поражения легких (изменения на ВРКТ по шкале Bhalla были выявлены у 26 (76,5 %) пациентов) и ОФВ1 более 80% [36]. В работе Owens CM и соавт. представлены результаты обследования 60 детей в возрасте от 6 до 10 лет, со сниженным ОФВ1 у 18 (32 %) пациентов [37]. Обследованные нами больные МВ были старше, имели более выраженное ухудшение ФВД и значительные структурные изменения, поэтому наши результаты отличны от итогов вышеперечисленных работ. Число взрослых больных МВ с нормальной спирометрией (n=9) было недостаточным для выделения этих больных в отдельную группу и проведения статистического анализа. Для оценки диагностических возможностей ВАМД у взрослых больных МВ с сохранной ФВД необходимы дальнейшие исследования.
Заключение
Проведенное нами исследование показало, что у взрослых больных МВ присутствует значительная неравномерность легочной вентиляции, прогрессирующая по мере нарастания структурных повреждений бронхолегочной системы и ухудшения ФВД. Статистически значимое увеличение MR подчеркивает вовлечение в патологический процесс не только центральных, но и периферических дыхательных путей. У взрослых больных МВ существует сильная корреляционная связь между LCI и выраженностью структурных изменений, определяемых с помощью ВРКТ, сопоставимая по силе и значимости с ОФВ1.
Авторы работы выражают благодарность сотрудникам отделения муковисцидоза и кабинета компьютерной томографии рентгеновского отделения ГБУЗ «Городской клинической больницы имени Д.Д. Плетнёва Департамента здравоохранения города Москвы».
Конфликт интересов отсутствует.
Исследование проводилось без участия спонсоров.
УЧАСТИЕ АВТОРОВ
А.В. Черняк - разработка дизайна проекта, набор клинического материала, анализ и интерпретация результатов, написание текста.
Г.В.Неклюдова – набор клинического материала, редактирование текста.
С.А.Красовский – разработка дизайна проекта, набор клинического материала, написание и редактирование текста.
К.Ю.Михайличенко – анализ и интерпретация результатов ВРКТ, редактирование текста.
Ж.К.Науменко – разработка дизайна проекта, набор клинического материала, редактирование текста.
Г.Э.Поливанов – анализ и интерпретация результатов ВРКТ.
Список литературы.
- Gibson R.L., Burns J.L., Ramsey B.W. - Pathophysiology and management of pulmonary infections in cystic fibrosis. Am.J.Respir.Crit.Care Med. 2003; 168: 918–9 DOI: 10.1164/rccm.200304-505SO.
- Красовский С.А., Черняк А.В., Амелина Е.Л., Никонова В.С., Воронкова А.Ю., Самойленко В.А., Науменко Ж.К., Каширская Н.Ю., Капранов Н.И., Шерман В.Д., Шабалова Л.А., Чистякова В.П., Симонова О.И., Семыкин С.Ю., Горинова Ю.В., Авакян Л.В., Петрова П.Н., Кусова З.А., Усачева М.В., Самсонова М.В., Черняев А.Л., Чучалин А.Г. - Динамика выживаемости больных муковисцидозом в Москве и Московской области за периоды 1992-2001 и 2002-2011 гг.. Пульмонология. 2012; 3: 79-86.
- Каширская Н.Ю. Красовский С.А., Черняк А.В., Шерман В.Д., Воронкова А.Ю., Шабалова Л.А., Никонова В.С., Горинова Ю.В., Симонова О.И., Амелина Е.Л., Кондратьева Е.И., Капранов Н.И., Петрова Н.В., Зинченко Р.А. - Динамика продолжительности жизни больных муковисцидозом, проживающих в Москве, и ее связь с получаемой терапией: ретроспективный анализ за 1993-2013гг. Вопросы современной педиатрии. 2015; 14 (4): 503-508. DOI: 15690/vsp.v14.i4.1390
- Регистр больных муковисцидозом в Российской Федерации. 2017 год. / Под редакцией А.Ю. Воронковой, Е.Л. Амелиной, Н.Ю. Каширской, Е.И. Кондратьевой, С.А. Красовского, М.А. Стариновой, Н.И. Капранова. – М.: ИД «МЕДПРАКТИКА-М», 2019, 68 с.
- Tiddens H.A. - Detectingearlystructurallungdamageincysticfibrosis. Pediatr.Pulmonol. 2002; 34: 228–231. DOI: 1002/ppul.10134.
- Nir M., Lanng S., Johansen H.K., Koch C. - Long-term survival and nutritional data in patients with cystic fibrosis treated in a Danish centre. Thorax. 1996; 51: 1023–1027. DOI: 1136/thx.51.10.1023.
- Frederiksen B., Lanng S., Koch C., Høiby N. --- Improved survival in the Danish centertreated cystic fibrosis patients: results of aggressive treatment. Pulmonol. 1996; 21: 153–158. DOI: 10.1002/(SICI)1099-0496(199603)21:3<153::AID-PPUL1>3.0.CO;2-R.
- Brody A.S., Tiddens H.A., Castile R.G., Coxson H.O., de Jong P.A., Goldin J., Huda W., Long F.R., McNitt-Gray M., Rock M., Robinson T.E., Sagel S.D.; CT Scanning in Cystic Fibrosis Special Interest Group. - Computed tomography in the evaluation of cystic fibrosis lung disease. Am. J. Respir.Crit. Care Med. 2005; 172: 1246–12 DOI: 10.1164/rccm.200503-401PP.
- Harun S.N., Wainwright C., Klein K., Hennig S. - A systematic review of studies examining the rate of lung function decline in patients with cystic fibrosis. Respir.Rev. 2016; 20: 55-66. DOI: 10.1016/j.prrv.2016.03.002.
- Hulzebos E.H., Bomhof-Roordink H., van de Weert-van Leeuwen P.B., Twisk J.W., Arets H.G., van der Ent C.K., Takken T. - Prediction of mortality in adolescents with cystic fibrosis. Med. Sci. Sports Exerc. 2014; 46 (11): 2047-2052. DOI: 10.1249/MSS.0000000000000344.
- Davies J., Sheridan H., Bell N., Cunningham S., Davis S.D., Elborn J.S., Milla C.E., Starner T.D., Weiner D.J., Lee P.S., Ratjen F. - Assessment of clinical response to ivacaftor with lung clearance index in cystic fibrosis patients with a G551D-CFTR mutation and preserved spirometry: a randomised controlled trial. Тhe Lancet. Respiratory medicine. 2013; 1 (8): 630-638. DOI: 10.1016/S2213-2600(13)70182-6.
- Черняк А.В., Красовский С.А., Горинова Ю.В., Воронкова А.Ю., Мухина М.А..- Функция внешнего дыхания и ее связь с нутритивным и микробиологическим статусом у больных муковисцидозом. Практическая пульмонология. 2018; 1: 43-50.
- Aurora P., Bush A., Gustafsson P., Oliver C., Wallis C., Price J., Stroobant J., Carr S., Stocks J.; London Cystic Fibrosis Collaboration. - Multiple-breath washout as a marker of lung disease in preschool children with cystic fibrosis. Am. J. Respir.Crit. Care Med. 2005; 171: 249–256. DOI: 1164/rccm.200407-895OC.
- Gustafsson P.M., Aurora P., Lindblad A. - Evaluation of ventilation maldistribution as an early indicator of lung disease in children with cystic fibrosis. Respir. J. 2003; 22: 972–979. DOI: 10.1183/09031936.03.00049502.
- Dressel H., Filser L., Fischer R., Marten K., Müller-Lisse U., de la Motte D., Nowak D., Huber R.M., Jörres R.A. - Lung diffusing capacity for nitric oxide and carbon monoxide in relation to morphological changes as assessed by computed tomography in patients with cystic fibrosis. BMC Pulm.Med. 2009; 9: 30. DOI:1186/1471-2466-9-30.
- Becklake M.R. - A new index of the intrapulmonary mixture of inspired air.Thorax.1952; 7: 111–116. DOI: 1136/thx.7.1.111.
- Kraemer R., Blum A., Schibler A., Ammann R.A., Gallati S. - Ventilation inhomogeneities in relation to standard lung function in patients with cystic fibrosis. Am. J. Respir.Crit. Care Med. 2005; 171: 371–378. DOI: 1164/rccm.200407-948OC.
- Davis S.D., Fordham L.A., Brody A.S., Noah T.L., Retsch-Bogart G.Z., Qaqish B.F., Yankaskas B.C., Johnson R.C., Leigh M.W.- Computed tomography reflects lower airway inflammation and tracks changes in early cystic fibrosis. Am. J. Respir.Crit.Care 2007; 175 (9): 943-950. DOI: 10.1164/rccm.200603-343OC.
- Ramsey K.A., Rosenow T., Turkovic L., Skoric B., Banton G., Adams A.M., Simpson S.J., Murray C., Ranganathan S.C., Stick S.M., Hall G.L.; AREST CF. - Lung Clearance Index and Structural Lung Disease on Computed Tomography in Early Cystic Fibrosis. Am. J. Respir.Crit.Care 2016; 193 (1): 60-67. DOI: 10.1164/rccm.201507-1409OC.
- Brody A.S., Klein J.S., Molina P.L., Quan J., Bean J.A., Wilmott R.W.- High-resolution computed tomography in young patients with cystic fibrosis: distribution of abnormalities and correlation with pulmonary function tests. J. Pediatr. 2004; 145: 32–38. DOI: 1016/j.jpeds.2004.02.038.
- Sanders D.B., Li Z., Brody A.S. – Chest computed tomography predicts the frequency of pulmonary exacerbations in children with cystic fibrosis. Ann.Am.Thorac. 2015; 12 (1): 64-69. DOI: 10.1513/AnnalsATS.201407-338OC.
- Sanders D.B., Li Z., Parker-McGill K., Farrell P., Brody A.S. - Quantitative chest computerized tomography and FEV1 equally identify pulmonary exacerbation risk in children with cystic fibrosis. Pediatr. 2018; 53 (10): 1369-1377. DOI: 10.1002/ppul.24144.
- Амелина Е.Л., Марченков Я.В., Черняк А.В., Красовский С.А. - Количественная оценка результатов компьютерной томографии высокого разрешения органов грудной клетки у взрослых больных муковисцидозом. Пульмонология. 2009; 1: 59-66.
- Smyth A.R., Bell S.C., Bojcin S., Bryon M., Duff A., Flume P., Kashirskaya N., Munck A., Ratjen F., Schwarzenberg S.J., Sermet-Gaudelus I., Southern K.W., Taccetti G., Ullrich G., Wolfe S.; European Cystic Fibrosis Society. – European Cystic Fibrosis Society Standards of Care: Best Practice guidelines. Cyst. Fibros. 2014; 13 Suppl 1: S23-42. doi: 10.1016/j.jcf.2014.03.010.
- Miller M.R., Hankinson J., Brusasco V., Burgos F., Casaburi R., Coates A., Crapo R., Enright P., van der Grinten C.P., Gustafsson P., Jensen R., Johnson D.C., MacIntyre N., McKay R., Navajas D., Pedersen O.F., Pellegrino R., Viegi G., Wanger J.; ATS/ERS Task Force.- Standardisation of spirometry. Eur. Respir. J. 2005; 26: 319-337. DOI: 1183/09031936.05.00034805.
- Wanger J., Clausen J.L., Coates A., Pedersen O.F., Brusasco V., Burgos F., Casaburi R., Crapo R., Enright P., van der Grinten C.P., Gustafsson P., Hankinson J., Jensen R., Johnson D., Macintyre N., McKay R., Miller M.R., Navajas D., Pellegrino R., Viegi G. - Standardisation of the measurement of lung volumes. Eur. Respir. J. 2005; 26: 511-522. DOI: 1183/09031936.05.00035005
- Macintyre N., Crapo R.O., Viegi G., Johnson D.C., van der Grinten C.P., Brusasco V., Burgos F., Casaburi R., Coates A., Enright P., Gustafsson P., Hankinson J., Jensen R., McKay R., Miller M.R., Navajas D., Pedersen O.F., Pellegrino R., Wanger J. - Standardisation of the single-breath determination of carbon monoxide uptake in the lung. Eur. Respir. J. 2005; 26: 720-735. DOI: 1183/09031936.05.00034905
- Robinson P.D., Latzin Ph., Verbanck S., Hall G.L., Horsley A., Gappa M., Thamrin C., Arets H.G.M., Aurora P, Fuchs S.I., King G.G., Lum S., Macleod K., Paiva M., Pillow J.J., Ranganathan S., Ratjen F., Singer F., Sonnappa S., Stocks J., Subbarao P., Thompson B.R., Gustafsson P.M. ERS/ATS Consensus statement for inert gas washout measurement using multiple- and singlebreath tests. Eur. Respir. J. 2013; 41: 507–522. DOI: 10.1183/09031936.00069712.
- Quanjer P.H., Tammeling G.J., Cotes J.E., Pedersen O.F., Peslin R., Yernault JC. – Lung volumes and forced ventilatory flows. Report Working Party Standardization of Lung Function Tests, European Community for Steel and Coal. Official Statement of the European Respiratory Society. Eur. Respir. J. 1993; 6 (Suppl.16): 5-40.
- Task group on surveillance for respiratory hazards in the occupational setting, Brooks S.M. (Chairman). Surveillance for respiratory hazards. ATS News 1982; 8: 12-16.
- Bhalla M., Turcios N., Aponte V., Jenkins M., Leitman B.S., McCauley D.I., Naidich D.P. - Cystic Fibrosis: Scoring System with Thin-Section CT. Radiology. 1991; 179 (3): 783-788. DOI: 1148/radiology.179.3.2027992.
- Robinson P.D., Goldman M.D., Gustafsson P.M. - Inert Gas Washout: Theoretical Background and Clinical Utility in Respiratory Disease. Respiration. 2009; 78 (3): 339-3 DOI: 10.1159/000225373.
- Shaw M., Oppelaar M.C., Jensen R., Stanojevic S., Davis S.D., Retsch-Bogart G., Ratjen F.A. - The utility of moment ratios and abbreviated endpoints of the multiple breath washout test in preschool children with cystic fibrosis. Pediatr. Pulmonol. 2020; 55 (3): 649-653. DOI: 10.1002/ppul.24618.
- Wielpütz M.O., Weinheimer O., Eichinger M., Wiebel M., Biederer J., Kauczor H.U., Heußel C.P., Mall M.A., Puderbach M. - Pulmonary emphysema in cystic fibrosis detected by densitometry on chest multidetector computed tomography. PLoS One. 2013; 21 (8): 73-142. DOI: 10.1371/journal.pone.0073142.
- Gustafsson P.M., De Jong P.A., Tiddens H.A., Lindblad A. - Multiple-breath inert gas washout and spirometry versus structural lung disease in cystic fibrosis. Thorax. 2008; 63 (2): 129-134. DOI: 1136/thx.2007.077784.
- Ellemunter H., Fuchs S.I., Unsinn K.M., Freund M.C., Waltner-Romen M., Steinkamp G., Gappa M. - Sensitivity of lung clearance index and chest computed tomography in early CF lung disease. Respir. Med. 2010; 104 (12): 1834-1842. DOI: 10.1016/j.rmed.2010.06.010.
- Owens C.M., Aurora P., Stanojevic S., Bush A., Wade A., Oliver C., Calder A., Price J., Carr S.B., Shankar A., Stocks J., London Cystic Fibrosis Collaboration. - Lung clearance index and HRCT are complementary markers of lung abnormalities in young children with CF. Thorax. 2011; 66 (6): 481-488. DOI: 10.1136/thx.2010.150375.
Информация об авторах:
Александр Владимирович Черняк – к.м.н., 1. Заведующий лабораторией функциональных и ультразвуковых методов исследования, Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства России. Адрес: 115682, г. Москва, Ореховый бульвар, д.28. 2. врач функциональной диагностики отделения функциональной и ультразвуковой диагностики, Государственное бюджетное учреждение здравоохранения города Москвы «Городская клиническая больница имени Д.Д. Плетнёва Департамента здравоохранения города Москвы». Адрес: 105077, г. Москва, 11-Парковая, д.32.
e-mail: achi2000@mail.ru, тел: +7 (917) 550-06-34; SPIN-код: 9328-6440, AuthorID: 687383, ORCID:https://orcid.org/0000-0002-2001-5504.
Неклюдова Галина Васильевна – д.м.н., 1. Ведущий научный сотрудник лаборатории функциональных и ультразвуковых методов исследования, Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства России. Адрес: 115682, г. Москва, Ореховый бульвар, д.28. e-mail: Nekludova_gala@mail.ru; тел: +7 (916) 296-01-64; SPIN-код: 8956-9125, AuthorID: 394036, ORCID: https://orcid.org/0000-0002-9509-0867.
Станислав Александрович Красовский, к.м.н., 1- старший научный сотрудник лаборатории муковисцидоза, Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства России. Адрес: 115682, г. Москва, Ореховый бульвар, д.28. 2. – врач-пульмонолог отделения муковисцидоза, Государственное бюджетное учреждение здравоохранения города Москвы «Городская клиническая больница имени Д.Д. Плетнёва Департамента здравоохранения города Москвы». Адрес: 105077, г. Москва, 11-Парковая, д.32. e-mail: sa_krasovsky@mail.ru, тел: +7 (926) 273-76-34; SPIN-код: 3385-6489, Author ID: 688178, ORCID: https://orcid.org/0000-0001-9642-0947.
Кирилл Юрьевич Михайличенко - 1. - научный сотрудник лаборатории патологической анатомии, Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства России. Адрес: 115682, г. Москва, Ореховый бульвар, д.28. 2. - врач-рентгенолог отделения лучевой диагностики, Городская клиническая больница имени М.П. Кончаловского Департамента здравоохранения города Москвы, Адрес: 124489, Зеленоград, Москва, Каштановая аллея, 2, стр. 7. e- mail: kirr.mih@gmail.com, тел: +7 (968) 822-63-35, SPIN–код: 1275-4522; AuthorID: 1019147, ORCID: https://orcid.org/0000-0002-9795-7022.
Жанна Константиновна Науменко – к.м.н., 1. Старший научный сотрудник лаборатории функциональных и ультразвуковых методов исследования, Федеральное государственное бюджетное учреждение «Научно-исследовательский институт пульмонологии» Федерального медико-биологического агентства России. Адрес: 115682, г. Москва, Ореховый бульвар, д.28. 2. врач функциональной диагностики отделения функциональной и ультразвуковой диагностики, Государственное бюджетное учреждение здравоохранения города Москвы «Городская клиническая больница имени Д.Д. Плетнёва Департамента здравоохранения города Москвы». Адрес: 105077, г. Москва, 11-Парковая, д.32. e-mail: naumenko_janna@mail.ru, тел: +7 (903) 270-27-16; SPIN-код: 7191-1758, AuthorID: 687383, ORCID: https://orcid.org/0000-0002-4804-6142.
Гайк Эдуардович Поливанов – к.м.н., врач-рентгенолог кабинета компьютерной томографии рентгеновского отделения, Государственное бюджетное учреждение здравоохранения города Москвы «Городская клиническая больница имени Д.Д. Плетнёва Департамента здравоохранения города Москвы». Адрес: 105077, г. Москва, 11-Парковая, д.32. e-mail: pulmoct@gmail.com, тел: +7 (926) 124-78-15.